クリプト植物の形態,分類,進化(第1版) |
| 執筆:大田修平 作成日:2010年10月17日 |
| はじめに |
| クリプト植物(クリプト藻)は池の水や海水をサンプリングすれば,比較的簡単に見つけることができる藻類です。クリプト植物は前回紹介したクロララクニオン植物と同様に,二次共生(真核-真核細胞内共生)によって葉緑体を獲得した生物群で,クロララクニオン植物と同様にヌクレオモルフを持っています。 クリプト植物は他の藻類群と比べて,いくつかユニークな特徴を共有しています。ここでは,クリプト植物について,系統,分類,形態的側面から解説し,最後に最近のヌクレオモルフ・ゲノミクスについて簡単に紹介したいと思います。 |
| 生息域 |
| クリプト植物は海水,淡水,汽水域に生息しています。淡水の場合は,取ってきたサンプルをそのまま顕微鏡で観察するとたいてい見つかります。海水の場合はサンプルをそのまま観察しても見つからないことがありますが,粗培養処理(予備培養処理)を行えば高い頻度で出現します。粗培養処理については「中高校生からの粗培養処理(近日公開)」をご覧ください。 |
| クリプト植物は何の仲間か?
クリプト植物の系統,分類学的位置,葉緑体の起源 |
| 系統的位置 |
| クリプト植物がどの仲間に近いかと言う問題は,最近まであまりよく分かっていませんでした。最近の分子系統学的研究により,クリプト植物はどうやらハプト植物が姉妹群であるらしいことが明らかになってきました(Patron et al. 2007など)。ハプト植物は単細胞藻類の一群で,海洋生態的に重要なグループとして知られています。海域でよく見つかるハプト植物にエミリアニア・ハックスレイ(Emiliania huxleyi)と呼ばれる円石藻があります。ではクリプト-ハプト植物群は生物界のどこに位置するのでしょうか?これも最近までよく分かっていませんでしたが,最近の大規模データに基づく分子系統解析により徐々に明らかになってきました。ここでは,Burki et al. (2009) に基づき真核生物におけるクリプト植物の系統的位置を見てみます。Burki et al. (2009) によると,クリプト植物は,有中心粒太陽虫類,テロネマ類およびハプト植物と単系統となるそうです(図1)。彼らは,この系統群をそれぞれのアルファベットの頭文字をとってCCTHグループと呼んでいます(cryptomonads-centrohelids-telonemids-haptophytes)。このCCTHグループはさらにSARと呼ばれるグループと姉妹群になるそうです(図1)。SARグループとは,ストラメノパイル-アルベオラータ-リザリア群のことで多細胞から単細胞を含む多種多様な生物の集まりです(詳しくは,生物の系統と分類(執筆中)をご覧ください)。このように,クリプト植物は真核生物において進化的に深い位置で分岐したグループであることが分かりました。 |
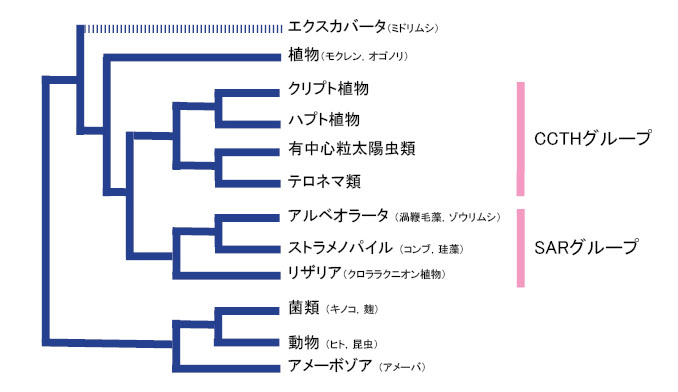 |
| 図1 真核生物の系統関係 |
| Burki et al. (2009) を基に作図しました。エクスカバータは多系統になっていたので,主要系統群のみを示しました。括弧内に身近な生物を表記しましたが,これはあくまでも一例で,系統群の代表ではありません。 |
| Cavalier-Smith (2010) に基づく高次分類体系 |
| ここでは高次分類体系を紹介します(注1)。Cavalier-Smith (2010) の体系では以下のようになります。ここでは,クリプト植物門はハクロビア亜界に置かれています。 |
| クロミスタ界 Kingdom Chromista (注1) | ||
| ハクロビア亜界 Subkingdom Hacrobia (注2) | ||
| クリプト植物門 Phylum Cryptista | ||
| (Cryptophyceae*, Goniomonadea**; Katablepharidea**, Telonemea**) | ||
| ハプト植物門 Phylum Haptophyta* | ||
| ヘリオゾア門 Phylum Heliozoa** Haeckel, 1862 emend. Cavalier-Smith, 2003 | ||
| 注1:系統関係が分かれば、高次分類系はいらない,という意見もあります。確かに,近年の大系統の論文には,系統関係と分類体系とが対応関係になっていないものもあり,分かりにくくなっていることも否めません。しかし,系統学と分類学は密接に関連してはいますが,本来別物です。分類学は分子系統を利用しますが,その他に遺伝学,細胞生物学,生態学,形態学などのデータを総合的に判断し,生物の歴史(自然史)をリンネ式階層分類体系に写し取る作業だと言えます。リンネ式階層分類体系の単位が種であり,種に与えられる学名が生物学共通の名称であることを考えると,リンネ式分類体系を用いて分類を記述する作業(分類体系を構築すること)は重要であるといえます。 | ||
| 注2:Cavalier-Smith (2010) の補遺によりますと,Okamoto et al. (2009) はハクロビアのランク(分類階級)を指定してなかったので,ハクロビア亜界の著者名はこのような表記になります。Okamoto et al. (2009)のハクロビアの定義は,「クリプト植物とハプト植物の共通祖先とその子孫」を含むグループとなっています。この定義に従うと,CCTHクレードはハクロビアではありませんが,Cavalier-Smith (2010) にはHeliozoaが含まれています。ここの整合性については現在精査中です。 | ||
| 注3:*は国際植物命名規約で扱うグループ,**は国際動物命名規約で扱うグループを意味します。 | ||
| 葉緑体の起源 | |||||||
| クロララクニオン植物場合,葉緑体の色は緑一色だけでしたが(色素体/葉緑体の成立と多様性;クロララクニオン植物の形態・分類・進化参照),クリプト植物の葉緑体の色はバリエーションがあり,赤色,褐色,緑(オリーブグリーン),青緑色などを呈します。クリプト植物の光合成色素は,主にクロロフィル a と c,カロテノイド,フィコビリンタンパク質(フィコシアニンとフィコエリトリン)からなり,このフィコビリンタンパク質の種類が葉緑体の色の違いを生み出しています。フィコビリンタンパク質についてはここでは詳しく述べませんが,クリプト植物のほか,灰色植物,紅色植物など特定の藻類グループに見られる補助色素のことです。灰色,紅色植物では,フィコビリンタンパク質はチラコイド膜上にフィコビリソームという構造体を作り,光合成のアンテナ色素として働きますが,クリプト植物のフィコビリンタンパク質はチラコイドの内腔部に組み込まれており,フィコビリソームを作りません(余談ですが,クリプト植物の電子顕微鏡の試料を作製すると,クロロフィル系の色素は有機溶媒で抜けますが,水溶性であるフィコビリンタンパク質は残るので電子顕微鏡試料がきれいな色を呈します。図2) クロララクニオン植物の葉緑体の起源は緑色植物でしたが,クリプト植物の葉緑体は紅色植物起源であることが明らかにされました(例えば,Douglas et al. 1991; Cavalier-Smith et al. 1996; Douglas et al. 1999; Douglas et al. 2001)。クリプト植物の(宿主側の)系統関係は最近になってようやく見えてきだした段階ですが,葉緑体の起源は,かなり早い段階で決着がついたといえます。2001年にはクリプト植物の一種のヌクレオモルフの全ゲノム配列の解読が終了し,現在は様々な種におけるヌクレオモルフゲノムサイズの比較や,別の種のゲノムを解読して,ヌクレオモルフ・ゲノム縮小機構の解明の研究が行われています(後述)。 | |||||||
 |
|||||||
| 図2 クリプト植物の透過型電子顕微鏡試料 矢印がクリプト植物の細胞塊 |
|||||||
| 細胞形態・微細構造 | ||
| 細胞形態・鞭毛 | ||
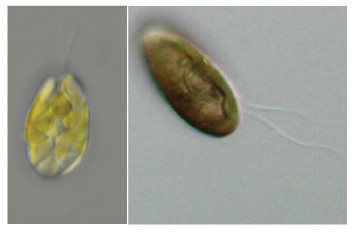
| 細胞は背腹にやや扁平で,楕円形,卵形,三日月形,尾状突起のあるS字形ですが,一般的によく言われる「米粒形」の細胞もよく観察されます。細胞の光学顕微鏡写真を図3に示しました。
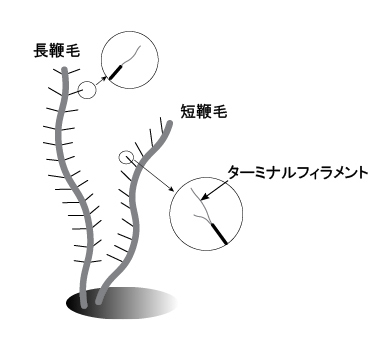
細胞の頂端部分には,縦溝-ガレット(咽喉部)系(furrow-gullet system)と呼ばれる,細胞頂端近傍から細胞長軸方向への陥入構造が観察できます。ここでは縦溝-ガレット系の詳しい構造の説明は割愛しますが,ガレットは細胞の陥入構造で,縦溝は陥入の口(vestibulum)の切れ込みと考えてください。縦溝-ガレット系はクリプト植物の特徴となっていますので,野外サンプルで見つかった鞭毛藻がクリプト植物かどうかを判断する際のポイントとなります。少なくとも5タイプの縦溝-ガレット系の形態的バリエーションが知られており,縦溝のみ,ガレットのみ,縦溝とガレット両方持つものなどがあります(Kugrens et al. 1986; Clay et al. 1999)。 一般的に,ガレットの陥入口の近傍から2本の不等長の鞭毛が出ています。少なくとも2本の鞭毛のうち1本には管状鞭毛小毛(tubular hairs)が観察されます(図4)。Kugrens et al. (1987) によると,鞭毛小毛の有無およびその配列パターンは少なくとも6タイプあると報告されています(注)。このバリエーションのなかで普通に見られるのは,長鞭毛に2列に鞭毛が並び,短鞭毛には1列に鞭毛小毛が並ぶタイプです(図4)。長鞭毛の鞭毛小毛は1本のターミナルフィラメントを持ち,一方,短鞭毛の鞭毛小毛は不等長のターミナルフィラメントを2本持ちます(図4; Kugrens et al. 1987; Clay et al. 2001)。 野外から採集したばかりのクリプト植物は元気に遊泳していることが多いので,生きた細胞を顕微鏡観察するのは難しいかも知れません。しかし中には遊泳しない細胞もいますので,顕微鏡観察に挑戦してみてください。 注:Kugrens et al. (1987) では管状鞭毛小毛をマスチゴネマ(mastigoneme)と表記していますが,この用語はストラメノパイル類の鞭毛小毛に対して付けられた用語である可能性もあり,正確を期すため,ここではマスチゴネマという用語は使わないことにしました。 (その後の文献精査で,マスチゴネマという用語は,Deflandre (1934a, b) が「すべての鞭毛小毛一般」に対して導入した用語であるらしいことがわかりました。同時にDeflandre (1934a, b) は,pantonematic, stichonematic などの鞭毛配列様式の細かな用語を設定しています。一方,Moestrup (1982) は様々な専門用語の乱立は混乱の原因であるとして,彼の総説(Moestrup 1982)の中では、鞭毛小毛をあらわす用語をTubular hairs と Simple (non-tublar) hairs の2つの専門用語に限っています。本記事では,Moestrup (1982) に従うことにしました。ちなみに,Moestrup (1982)は,藻類の鞭毛に関する詳しいレビューですので,ご興味ある方はご一読ください。Phycologia誌21巻4号がまるごと一本のレビューとなっています。) |
||
 |
 |
|
| 図3 クリプト植物の光学顕微鏡写真 | 図4 クリプト植物の鞭毛の模式図 | |
| 左:クロオモナス属の一種(黒海産) 右:クリプトモナス属の一種(霞ヶ浦産) |
ここでは1タイプのみを描いています。長鞭毛にある鞭毛小毛のターミナルフィラメントが1本であるのは,全ての群で共通しています。 | |
| ペリプラスト・細胞外皮構造 | ||
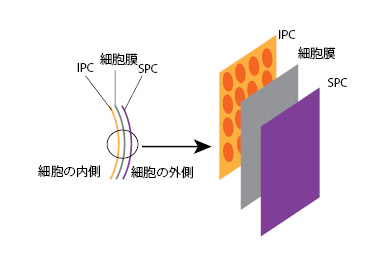
| クリプト植物はペリプラストと呼ばれるユニークな細胞外皮構造を持ちます。クリプト植物の外皮は,細胞膜(原形質膜)を挟むように内側にインナーペリプラストコンポーネント(IPC)と呼ばれるプレートがあり,外側にはサーフェイスペリプラストコンポーネント(SPC)と呼ばれるプレートがあります(図5)。IPCおよびSPCはタンパク質でできており,分類群間で形態的バリエーションがあるため(例:六角形プレート,卵形プレート),識別形質として用いられています(注:プレートの模様は,電子顕微鏡でしか観察できない特徴です)。 | ||
 |
||
| 図5 細胞外皮構造の模式図 | ||
| IPC: インナーペリプラストコンポーネント, SPC: サーフェイスペリプラストコンポーネント | ||
| エジェクトソーム(射出装置) | ||
| クリプト植物は2種類のエジェクトソーム(射出装置)を持っています。縦溝-ガレット系に配置されているやや大きいエジェクトソーム(furrow-gullet ejectosome)と細胞表面にある小さいエジェクトソーム(periplast ejectosome)です。エジェクトソームは2つの長さの異なるリボンがコイル状に巻かれた構造をしており(Morrall and Greenwood 1980),化学的あるいは物理的刺激によりリボンが射出します。エジェクトソームの役割は捕食者からの防御などが考えられています。 | ||
| 葉緑体・ヌクレオモルフ | ||
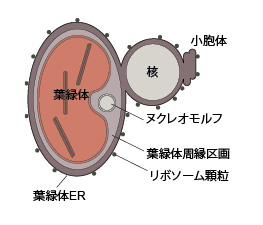
| 葉緑体は4重の包膜で囲まれています(図6)。クロララクニオン植物の葉緑体も4重膜ですが、クリプト植物は葉緑体の最外膜と核膜の外膜がつながっており,そこにリボソーム顆粒が付着している点が異なり,この膜は葉緑体ERと呼ばれています(詳しくは,色素体/葉緑体の成立と多様性をご覧ください)。
ヌクレオモルフ(共生藻の退化核)を持つ生物群は前回紹介したクロララクニオン植物とクリプト植物だけです。クリプト植物のヌクレオモルフは,クロララクニオン植物と同様に,葉緑体周縁区画に存在し,二重の包膜で囲まれています。ヌクレオモルフは3本の染色体を持ち,実際に遺伝子をコードしています。クロララクニオン植物とクリプト植物のヌクレオモルフの比較は,クロララクニオン植物の形態・分類・進化をご覧ください。 |
||
 |
||
| 図6 葉緑体,ヌクレオモルフ,核の関係を示した模式図 | ||
| ピレノイド,核膜孔,ヌクレオモルフ膜のギャップは省略しています。 | ||
| ミトコンドリア | ||
| ミトコンドリアは板状クリステを持っています。板状クリステを持つミトコンドリアは,藻類の中では比較的珍しいタイプであると言えます。 | ||
| キロモナス(Chilomonas)について | ||
| キロモナスは淡水を採集すると普通に見られる無色のクリプト植物です。従属栄養クリプト植物は他にゴニオモナス(Goniomonas)が知られていますが,ゴニオモナスは光合成能を獲得する前に分岐した分類群です。一方,キロモナスは一度葉緑体を獲得した後,光合成能を失ったもので,ロイコプラスト(白色体)と呼ばれる無色の葉緑体を持っており,ヌクレオモルフが付随しています。
色の有無は見た目にはっきりと分かるので,キロモナスは独立した属として扱われてきました。しかし,最近の分子系統解析では,キロモナスはクリプトモナス(Cryptomonas)と近縁である(正確に言うと,クリプトモナスと単系統群をなす)ことから,Hoef-Emden (2003) はキロモナス属をクリプトモナス属に統合し,キロモナスをクリプトモナスの異名(シノニム)としました。したがってHoef-Emden (2003) に従えば,従来知られていたキロモナス・パラメシウムは,Cryptomonas paramecium (Ehrenberg) Hoef-Emden et Melkonian (2003) と表記されます。 |
||
| ヌクレオモルフのゲノミクス | ||
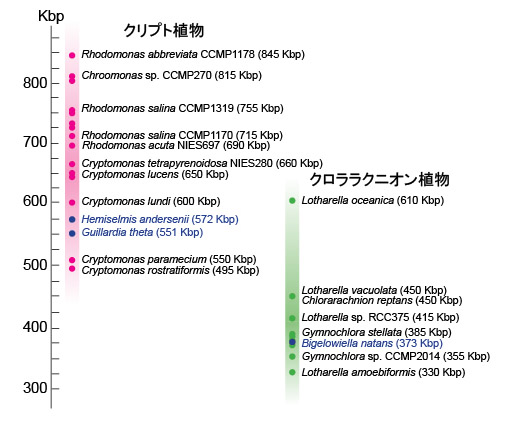
| クロララクニオン植物の項でも述べましたように,ヌクレオモルフは共生藻の退化核で,やがて消え行くものだと考えられています(Gilson et al. 2006)。この考え方に立つと,クロララクニオン植物とクリプト植物は葉緑体の獲得における進化的途中段階と言うことができます。このため,これらの材料を用いれば,細胞内共生における共生藻から葉緑体にいたる進化の途中過程を垣間見ることができます。特に,クロララクニオン植物とクリプト植物は完全に独立に進化してきたので,両分類群のヌクレオモルフのゲノムの類似点,相違点を調べることで,ゲノム縮小の謎がより多角的に理解できます。現在,ヌクレオモルフの全ゲノム解読は,クリプト植物では,Guillardia theta (Douglas et al. 2001), Hemiselmis andersenii (Lane et al. 2007),クロララクニオン植物では,Bigelowiella natans (Gilson et al. 2006) において終了しています。 並行してヌクレオモルフのゲノムサイズを推定し、比較する研究も行われています(例えば,Lane and Archibald 2006, 2008; Phipps et al. 2008; Tanifuji et al. 2010)。Tanifuji et al. (2010) などの研究によると,クリプト植物のヌクレオモルフゲノムのサイズは495 kbp(キロ塩基対)~845 kbpと見積もられています。一方,クロララクニオン植物のゲノムサイズは330 kbp~610 kbpと見積もられており(Silver et al. 2007),両クループを比較すると,クロラララクニオン植物のほうがやや小さいゲノムサイズの傾向にあります(図7)。今後,さらに新規分類群(新種)を発見し,それらをゲノム解析に加えることで,ヌクレオモルフゲノムサイズの分布域,分布の中心などが徐々に見えてくると思います。 |
||
 |
||
| 図7 ヌクレオモルフのゲノムサイズの分布を示した図 | ||
| Archibald and Lane (2009) のFig. 1を基に作図し,Tanifuji et al. (2010) のデータを加えました。縦軸はゲノムサイズ(Kbp; キロ塩基対)を示します。青で示した種はゲノム配列解読によりゲノムサイズが確定してい ることを示します。それ以外は,パルスフィールド電気泳動法による推定値です。 |
||
| Tanifuji et al. (2010) は,これまでで最も小さいヌクレオモルフゲノムサイズ(495 kbp)を持つクリプト植物(Cryptomonas rostratiformis)を報告しました。興味深いことに,このゲノムサイズは無色のクリプト植物よりも小さく(Cryptomonas paramecium のゲノムサイズ = 505 kbp),分子系統樹上の姉妹群(最も近縁な種)とは195 kbpもの差がありました。このような近縁群間でのヌクレオモルフのゲノムサイズのバラつきは,他の系統群でも見られました。このことは,ヌクレオモルフのゲノム縮小が,それぞれの系統において独立に複数回,異なる縮小率で起こった(起こっている)ことを示唆しています。近縁群間でヌクレオモルフのサイズが異なる原因として,遺伝子間の長さが異なること,オープンリーディングフレーム(ORF)の数が異なることなどが考えられますが,今後は,他の分類群でゲノムを解読し比較することで、ヌクレオモルフのゲノムサイズのバラつきの謎に迫ることができると思います。 | ||
| 最後に | ||
| クリプト植物は1831年にエーレンベルク(Ehrenberg)により発見され、水があれば基本的にどこにでもいる生物です。そんな生きものが最近、葉緑体の進化を探る研究で脚光を浴びています。現在ではクリプト植物はゲノム生物学的な研究で盛んに用いられるようになってきました。最近Not et al. (2007) が,クリプト植物に近いがクリプト植物ではない「ピコビリ藻」の存在を示唆しましたが,その実体はまだ明らかにされていません。ピコビリ藻はヌクレオモルフがあるらしく,今後の大系統研究では重要なグループのひとつになると思います。この藻類の今後の分類学研究に期待したいところです。 | ||
| 参考文献 | ||
| Archibald, J.M. and Lane, C.E. 2009. Going, going, not quite gone: nucleomorphs as a case study in nuclear genome reduction. Journal of Heredity 100: 582-590. | ||
| Burki, F., Inagaki, Y., Bråte, J., Archibald, J., Keeling, P., Cavalier-Smith, T., Sakaguchi, M., Hashimoto, T., Horak, A., Kumar, S. et al. 2009. Large-scale phylogenomic analyses reveal that two enigmatic protist lineages, telonemia and centroheliozoa, are related to photosynthetic chromalveolates. Genome Biology and Evolution 27: 231-238. | ||
| Cavalier-Smith, T., Couch, J.A., Thorsteinsen, K.E., Gilson, P., Deane, J.A., Hill, D.R.A. and McFadden, G.I. 1996. Cryptomonad nuclear and nucleomorph 18S rRNA phylogeny. European Journal of Phycology 31: 315–28. | ||
| Cavalier-Smith, T. 2010. Kingdoms Protozoa and Chromista and the eozoan root of the eukaryotic tree. Biology Letters 6: 342-345. | ||
| Clay, B.L., Kugrens, P. and Lee, R.E. 1999. A revised classification of the Cryptophyta. Biological Journal of the Linnean Society 131: 131-151. | ||
| Clay, B.L., Kugrens, P. and Lee, R.E. 2001. Cryptomonads. In: Encyclopedia of Life Sciences (ELS). John Wiley & Sons, Ltd: Chichester. DOI: 10.1038/npg.els.0001976. | ||
| Deflandre, G. 1934a. Existence, sur les flagelles, de filaments latéraux ou terminaux (mastigonèmes). Comptes Rendus de l'Académie des Sciences 198: 497-499. | ||
| Deflandre, G. 1934b. Sur la structure des flagelles. Ann. de Protistol. 4: 31-53. | ||
| Douglas, S.E., Murphy, C.A., Spencer, D.F. and Gray, M.W. 1991. Cryptomonad algae are evolutionary chimaeras of two phylogenetically distinct unicellular eukaryotes. Nature 350: 148-151. | ||
| Douglas, S.E. and Penny, S.L. 1999. The plastid genome of the cryptophyte alga, Guillardia theta: Complete sequence and conserved synteny groups confirm its common ancestry with red algae. Journal of Molecular Evolution 48: 236-244. | ||
| Douglas, S.E., Zauner, S., Fraunholz, M., Beaton, M., Penny, S., Deng, L.T., Wu, X., Reith, M., Cavalier-Smith, T. and Maier, U.G. 2001. The highly reduced genome of an enslaved algal nucleus. Nature 410: 1090-1096. | ||
| Gilson, P., Su, V., Slamovits, C., Reith, M., Keeling, P. and McFadden, G. 2006. Complete nucleotide sequence of the chlorarachniophyte nucleomorph: nature's smallest nucleus. Proceedings of the National Academy of Sciences of the United States of America 103: 9566-9571. | ||
| Hoef-Emden, K. and Melkonian, M. 2003. Revision of the genus Cryptomonas (Cryptophyceae): a combination of molecular phylogeny and morphology provides insights into a long-hidden dimorphism. Protist 154: 371-409. | ||
| Kugrens, P., Lee, R.E. and Andersen, R.A. 1986. Cell form and surface patterns in Chroomonas and Cryptomonas cells (Cryptophyceae) as revealed by scanning electron microscopy. Journal of Phycology 22: 512-522. | ||
| Kugrens, P, Lee, R.E. and Andersen, R.A. 1987. Ultrastructural variations in cryptomonad flagella. Journal of Phycology 23: 511-518. | ||
| Lane, C.E. and Archibald, J.M. 2006. Novel nucleomorph genome architecture in the cryptomonad genus Hemiselmis. Journal of Eukaryotic Microbiology 53: 515–21. | ||
| Lane, C.E. and Archibald, J.M. 2008. New marine members of the genus Hemiselmis (Cryptomonadales, Cryptophyceae). Journal of Phycology 44: 439–50. | ||
| Lane, C.E., van den Heuvel, K., Kozera, C., Curtis, B.A., Parsons, B.J., Bowman, S. and Archibald, J.M. 2007. Nucleomorph genome of Hemiselmis andersenii reveals complete intron loss and compaction as a driver of protein structure and function. Proceedings of the National Academy of Sciences of the United States of America 104: 19908-19913. | ||
| Moestrup, Ø. 1982. Flagellar structure in algae: a review, with new observations particularly on the Chrysophyceae, Phaeophyceae (Fucophyceae), Euglenophyceae, and Reckertia. Phycologia 21: 427-528. | ||
| Morrall, S. and Greenwood, A.D. 1980. A comparison of the periodic substructures of the trichocysts of the Cryptophyceae and Prasinophyceae. BioSystems 12: 71-83. | ||
| Not, F., Valentin, K, Romari, K, Lovejoy, C, Massana, R, Toebe, K., Vaulot, D. and Medlin, L. 2007. Picobiliphytes: A marine picoplanktonic algal group with unknown affinities to other eukaryotes. Science 315: 253-255. | ||
| Okamoto, N., Chantangsi, C., Horák, Leander, B.S. and Keeling, P.J. 2009. Molecular phylogeny and description of the novel katablepharid Roombia truncata gen. et sp. nov., and establishment of the Hacrobia taxon nov. PLoS One 4: e7080. | ||
| Patron, N.J., Inagaki, Y. and Keeling, P.J. 2007. Multiple gene phylogenies support the monophyly of cryptomonad and haptophyte host lineages. Current Biology 17: 887-891. | ||
| Phipps, K.D., Donaher, N.A., Lane, C.E. and Archibald, J.M. 2008, Nucleomorph karyotype diversity in the freshwater cryptophyte genus Cryptomonas. Journal of Phycology 44: 11–14. | ||
| Silver, T.D., Koike, S., Yabuki, A., Kofuji, R., Archibald, J.M. and Ishida, K. 2007. Phylogeny and nucleomorph karyotype diversity of chlorarachniophyte algae. Journal of Eukaryotic Microbiology 54: 403-410. | ||
| Tanifuji, G, Onodera, N.T. and Hara, Y. 2010. Nucleomorph genome diversity and its phylogenetic implications in cryptomonad algae. Phycological Research 58: 230-237. | ||
| >藻類・原生生物の分類と解説 | ||
| 「生きもの好きの語る自然誌」のトップに戻る | ||
| © 2010 Shuhei Ota | ||