|
クロララクニオン植物の形態,分類,進化(第2版) |
| 執筆:大田修平 作成日:2010年9月19日 改訂日:2011年4月22日 |
| |
| はじめに |
| |
| クロララクニオン植物は藻類の一グループですが,分類群としては小さく,これまで生態的重要性は低いと思われてきました。しかし最近のメタゲノム研究(海水などの海洋環境中から直接遺伝子を調べる研究)などにより,クロララクニオン植物は海洋において広範囲に分布していることが示唆されています (Medlin et al. 2006; Not et al. 2007)。またクロララクニオン植物と同じ仲間であるケルコゾア,放散虫,有孔虫は海洋生態的あるいは地球科学的に重要な生物群として考えられています。さらに,クロララクニオン植物は,葉緑体進化に関する細胞進化学分野において重要なグループとして注目されています。後ほど詳しく述べますが,クロララクニオン植物は,真核生物の中に真核生物が入れ子状態で入っており,細胞形態的にユニークな構造をしています。この細胞内に共生した真核生物(共生者)は,葉緑体として機能しており,もはや宿主外では単独で生存できませんが,ヌクレオモルフと呼ばれる退化核を今なお保持しています。このように現代生物学の流れの中で,クロララクニオン植物は少しづつ注目され始めており,毎年,新しい知見が次々と報告されています。最近では,クロララクニオン植物門に新たな属が設立され(Ishida et al. 2011),さらにヌクレオモルフ・ゲノミクスにおける新知見も報告されました(Silver et al. 2010)。今回,「クロララクニオン植物の形態,分類,進化」第2版では,第1版を大幅改訂し、クロララクニオン植物に関する最新の知見を盛り込みました。 |
| |
| クロララクニオン植物の系統,分類学的位置,葉緑体の起源 |
| |
| クロララクニオン植物は海産の単細胞藻類の仲間で,系統的にケルコゾア生物群と呼ばれるグループに位置しています (Bhattacharya et al. 1995; Ishida et al. 1999; Keeling 2001; Bass et al. 2005)。ケルコゾア生物とは原生生物(単細胞真核生物)の一群で,1998年キャバリエ・スミスが提唱したグループです (Cavalier-Smith et al. 1998)。これまでケルコゾア生物は分子系統解析の結果のみでまとめられ,形態的に共通する構造は知られていませんでした。しかし最近,ケルコゾア生物群の共有派生形質(共通の形質)が報告され,形態・微細構造による定義が可能となりました (Cavalier-Smith et al. 2008)。その形質とは,鞭毛基部付近で観察される微細構造で,鞭毛横断面を原形質膜より少し上のところで観察した場合,鞭毛の二連管の内側に九角形状の繊維構造が見られること,および原形質膜レベルで鞭毛横断面を見た場合,車軸状ラチス構造が見られることです(注:ケルコゾアの車軸状ラチス構造は原形質膜レベルにあり,従来の車輪構造とは異なります)。ケルコゾアの細胞は形態的に非常に多様です。その多くはアメーバ状を呈することが多いのですが,鞭毛ステージ,細胞壁を持った球状ステージを持つ種もあります。ケルコゾア生物は海水,淡水,土壌などで比較的普通に見ることができますが,特に土壌の生態系において,主要な微生物構成要素のひとつです (Bass & Cavalier-Smith 2004; Richards & Bass 2005)。身近な例では,植物の根に寄生するネコブカビ類などもケルコゾアの仲間です。 |
| |
| ケルコゾアはさらに「リザリア」と呼ばれる真核生物の巨大系統群(スーパーグループ)に属しています (Burki et al. 2006, 2008, 2009) (さらに詳しくは,写真で見る生物の系統と分類をご参照ください)。リザリアとは2002年にCavalier-Smithが提唱したグループで,全て真核単細胞生物から構成されています。身近な例では,放散虫や有孔虫などもリザリアの仲間です(図1)。ケルコゾア,放散虫,有孔虫はそれぞれ良くまとまった分類群ですが,この3つの分類群をリザリアとしてまとめる共通の形態的特徴はまだ見つかっていません。リザリアとは植物の根を意味するギリシア語rhizoが語源となっています。その名のとおり,リザリア生物の多くは,アメーバ状ステージを持ち,仮足(擬足)が糸状に分枝します。ケルコゾア生物の分類については,ケルコゾアの分類体系をご覧ください。 |
| |
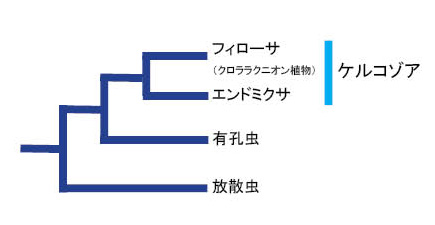 |
| 図1. リザリアの系統関係: Bass et al. 2005をもとに作図した。リザリア内の主要系統群のみを示した。 |
| |
| Cavalier-Smith (2010) は,リザリアをクロミスタ界の一群として扱っていますが,研究者によってリザリアの分類学的位置の取扱いは異なります(詳しくは「大系統の変遷(仮称)」を参照して下さい)。ただし,最近の分子系統解析によると,共有派生形質は見つかっていないものの,リザリアが単系統群であることはほぼ確実なようですので(たとえば,Burki et al. 2006),分類群としてまとめるのは妥当だと思います。 |
| |
| このようにみると,ケルコゾアはほとんどが従属栄養生物で,光合成生物はクロララクニオン植物を除いて他にないことに気づかされます(例外的に,Paulinella chromatophoraというシアノバクテリアを共生させたケルコゾアがいますが,これについては植物学会がオンライン発行している総説,植物科学の最前線1: 21-26をご覧ください)。では,クロララクニオン植物の葉緑体の起源は何でしょうか?クロララクニオン植物は一次植物(陸上植物を含む狭義の植物=緑色植物,紅色植物,灰色植物)と異なり,ケルコゾアのフィローサと呼ばれるグループの一系統群が緑藻の1種を細胞内に取り込み,細胞内共生を経て,成立した光合成生物であることが知られています(図2)(Ishida et al. 1999; Takahashi et al. 2009)。細胞内に取り込まれた緑藻は,現生のどの系統群に近いかという研究もいくつか報告されており,Takahashi et al. (2009) によると,プラシノ藻とよばれる単細胞性の緑藻に近いことが示唆されています。クロララクニオン植物のように,従属栄養真核生物が光合成真核生物を細胞内に取り込み成立した植物を,一次植物に対して,二次植物(あるいは,二次共生生物)と呼んでいます。身近な例では,池,沼地で普通に見られるユーグレナ植物(ミドリムシ)も緑藻起源の葉緑体を持つ二次植物です。(一次共生,二次共生,藻類の葉緑体の起源についてさらに詳しく知りたい方は,葉緑体の成立と多様性を参照してください。または,和文で読める好著,井上 (2009) をご参照ください。) |
| |
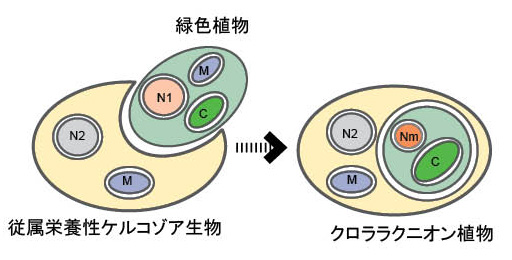 |
| 図2. クロララクニオン植物の成立過程を示した模式図 |
| 共生藻核(N1)がヌクレオモルフとなっていることに注意。(M=ミトコンドリア,N1= 共生藻核,N2= 宿主核,Nm=ヌクレオモルフ,C=葉緑体) |
| |
| 細胞形態 |
| |
| クロララクニオンとはギリシア語で「緑色のクモの巣」を意味します。その名のとおり,最初に発見されたChlorarachnion reptansは緑色の葉緑体を持ったアメーバ状細胞で,その仮足が互いに融合し,クモの巣状の網目構造を持つ種として報告されました (Gietlar 1930)(図3a)。2011年現在,クロララクニオン植物には12種が記載されていますが,そのうち半数の6種が生活環においてアメーバ状のステージを持っています。基本的なアメーバ状細胞の形態は複数本の糸状仮足を放射状に伸ばした円形から多角形,あるいは星形状を呈しますが,細胞壁を持たないため不定形であることも多く,またアメーバ運動する際は,多くは紡錘形となります。アメーバ状細胞は大きく分けると,細胞同士の仮足が融合し,ネットワーク構造(網状仮足)を作るタイプと,仮足が融合せず,単独のアメーバ状細胞であるタイプがあります。この仮足の性質は種によって異なるようです。アメーバ状細胞の次に多いタイプは,球状細胞です(図3b)。生活環内においてアメーバ状ステージを持たず生活環のほぼ全てが球状ステージで構成される種は3種報告されています。球状細胞は基本的に細胞壁を持ちますが,裸の球状を呈する種 (Lotharella oceanica) も報告されています (Ota et al. 2009a)。 |
| |
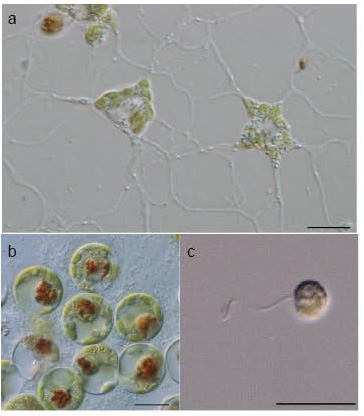 |
| 図 3. クロララクニオン植物の細胞形態(スケールは全て10 μm)
a: Chlorarachnion reptans(網状
仮足を持つアメーバ状細胞), b:
Lotharella vacuolata(球状細胞)
c: Bigelowiella longifila(鞭毛藻) |
| |
| クロララクニオン植物のほとんどの種で,生活環において1本鞭毛を持った遊泳細胞のステージ持ちますが,多くの場合,生活環のごく一部に出現するだけです。ただし,少数ではありますが,生活環の主要ステージが遊泳細胞である種も知られています(図3c)。Bigelowiella属は栄養細胞が遊泳細胞です。この場合,遊泳細胞・遊走子は用語を区別して使っています。遊泳細胞も遊走子も鞭毛を持つ細胞ですが,遊走子は遊泳ステージのまま分裂を行いません。最近報告されたPartenskyella glossopodiaは地中海産のピコプランクトンとして報告されました。ピコプランクトンとは細胞直径が3 µm以下の微小プランクトンの総称ですが,シアノバクテリア,緑色植物や不等毛植物など様々な系統群でその存在が知られており,海洋生態的に無視できないカテゴリーとして認識されるようになりました。P. glossopodiaは,2009年にクロララクニオン植物としては初めてのピコプランクトンの種として報告されました (Ota et al. 2009b)。 |
| |
クロララクニオン植物のアメーバ状細胞から伸びる仮足は非常に細く,このため糸状仮足と呼ばれています。同じアメーバ状細胞でもアメーボゾアとして分類されるいわゆるアメーバとは異なり,仮足には微小管が通っています。(アメーボゾアの場合は,基本的に糸状仮足を形成しません。)この糸状仮足の役目は良く分かっていませんが,おそらく,餌の捕食と移動,基質(砂,海藻表面)への付着が主な役割と考えられます(仮足運動の様子はムービーをご覧ください。)
 | | From Chlorarachniophytes |
|
| |
| 微細構造 |
| ここではクロララクニオン植物の電子顕微鏡レベルの構造(微細構造)について紹介します。クロララクニオン植物の共通の特徴として,4重膜で囲まれた葉緑体と,突出したピレノイドがあります。ピコプランクトンのP. glossopodiaには,例外的に突出したピレノイドはありませんが,これは細胞サイズを小さくする適応だと考えられています (Ota et al. 2009b)。ミトコンドリアは管状クリステで,核は通常1個,細胞壁の有無は種によって異なります。鞭毛を持つ場合は,鞭毛は1本で,基底小体は二つあります。 |
| |
| クロララクニオン植物の微細構造において,特に葉緑体とピレノイドの構造は,属の定義に用いられているので,ここで詳しく紹介したいと思います。ピレノイドとは,多くの藻類の葉緑体に見られる細胞小器官で,一般的には光合成のカルビン回路(炭酸固定)に関与している部分だと考えられています。クロララクニオン植物のピレノイドは突出した球根形で,光学顕微鏡によっても観察することができます(図4)。クロララクニオン植物のピレノイドは,微細構造的に異なる4つのタイプが知られています。私はそれぞれのタイプのピレノイドを,深裂型,管状陥入型,ヌクレオモルフ内包型,浅裂型と呼んでいます。深裂型ピレノイドとは葉緑体4重包膜のうちの内側の2枚がピレノイドの先端部から基部の方に向かって板状に陥入しており,しかもその陥入がピレノイドの基部付近まで達しているタイプで,Lotharella属とAmorphochlora属がこのタイプのピレノイドを持っています(図5a, b)。両属はさらに栄養細胞の形質によって区別されます(Ishida et al. 2011)。管状陥入型ピレノイドは葉緑体の最内膜(外から数えて4番目の膜)がピレノイド・マトリックスの中に管状に細かく陥入しているタイプで,Gymnochlora属の特徴となっています(図5c, d)。ヌクレオモルフ内包型ピレノイドとは,ピレノイドの先端部分にヌクレオモルフが存在するタイプで,Chlorarachnion属の特徴となっています(図5e, f)。最後に,浅裂型ピレノイドとは,葉緑体4重包膜のうちの内側の2枚がピレノイドに陥入しますが,Lotharella属のように深く陥入せず,陥入の程度が浅いタイプです。Bigelowiella属とNorrisiella属がこのタイプのピレノイドを持っています(図5g, h, i)。この2つの属も栄養細胞の形質で区別できます(Ota et al. 2007a, b)。 |
| |
 |
|
 |
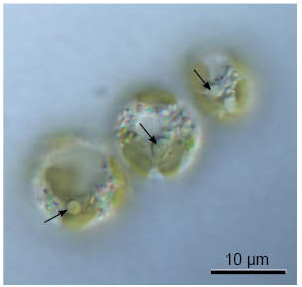
| 図4. クロララクニオン植物の微分干渉電子顕微鏡写真。矢印はピレノイド。 |
|
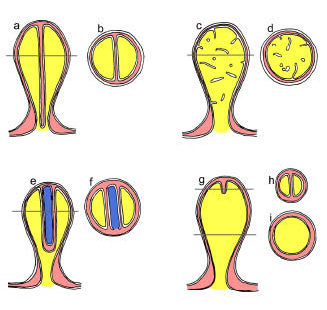
図5 ピレノイドの模式図
a:深裂型ピレノイドの縦断面構造。 b: 深裂型ピレノイド
の横断面構造。 c:管状陥入型ピレノイドの縦断面構造。
d: 管状陥入型ピレノイドの横断面構造。 e:ヌクレオモルフ内包型ピレノイドの縦断面構造。 f: ヌクレオモルフ内包型ピレノイドの横断面構造。 g:浅裂型ピレノイドの縦断面構造。 h: 浅裂型ピレノイドの横断面構造(ピレノイド先端付近) i: 浅裂型ピレノイドの横断面構造(ピレノイド中央部付近)。 |
| |
| 分布 |
| |
| 1980年代,クロララクニオン植物が認識されて間もない頃は,熱帯,亜熱帯域の海岸の砂,海藻の表面に付着する藻として発見されることが多かったため,暖かい海の海岸に分布の中心を持つと考えられてきました。しかし最近のメタゲノム研究によると,クロララクニオン植物は,外洋域あるいはやや寒い海域にも分布していることが明らかになり,実は広範囲な分布域を持つようです (Medlin et al. 2006; Not et al. 2007)。経験的に,やはり熱帯から温帯の沿岸域(たとえば珊瑚礁域,砂浜)のほうが,クロララクニオン植物の出現頻度が比較的高いような感じを受けます。ただし厳密に分布や生息場所を解明するためにはもう少し詳細な研究を待たなければなりません。 |
| |
| ヌクレオモルフ |
| |
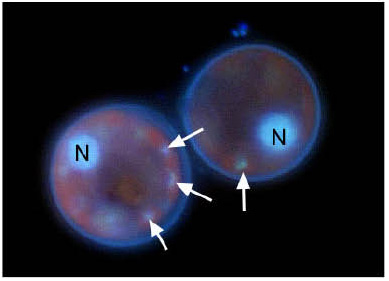
| ヌクレオモルフとは,葉緑体周縁区画(葉緑体4重包膜の内側の2重膜と外側の2重膜の間のスペース)に存在する2重膜で囲まれた核に似た構造体です。ヌクレオモルフは二次共生によって取り込まれた真核光合成生物(共生藻)の痕跡的な核と考えられ,この事実はMcFadden et al. (1994) によって証明されました。ヌクレオモルフは核酸を染色する試薬(DAPIなど)を用いても,その存在を観察することができます(図6)。クロララクニオン植物の場合,ヌクレオモルフはピレノイドの基部付近にあるか,あるいはピレノイドの先端部に埋まるような状態で存在しています(図7)。透過型電子顕微鏡で観察すると,ヌクレオモルフの周縁部分に電子密度の高い顆粒の存在が認められますが,これが何であるかはまだ分かっていません(図7b)。生物全体を見回して,ヌクレオモルフを持つ生物群は,クリプト植物とクロララクニオン植物しかありません。クリプト植物は淡水,海水域で比較的普通に出現する単細胞性藻類で,紅色植物(紅藻類)起源の葉緑体を持っています。 |
| |
|
|
 |
|
 |
| 図6. DAPI染色したクロララクニオン植物の細胞。矢印で示した部分がヌクレオモルフ。赤く見えるのは葉緑体の自家蛍光。Nは宿主の核。 |
|
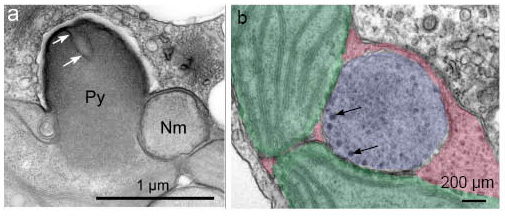
図7 クロララクニオン植物の透過型電子顕微鏡写真
a:浅裂型ピレノイドの例(Py=ピレノイド,Nm=ヌクレオモルフ)b:クロララクニオン植物のヌクレオモルフの透過型電子顕微鏡写真(分かりやすいように色を塗ってます)緑:葉緑体ストロマ,赤:葉緑体周縁区画,青:ヌクレオモルフ。矢印はヌクレオモルフの周縁部にみられる電子密度の高い顆粒。 |
| |
| ヌクレオモルフは独自のゲノムを持っていますが,そのゲノムサイズは極端に縮小しています(表1)。分類群ごとに多少のばらつきがありますが,クロララクニオン植物の場合,ヌクレオモルフゲノムサイズは,330kbp~610kbpと報告されています (Silver et al. 2007)。最近,クロララクニオンのヌクレオモルフゲノムのリボソーマルDNAとテロメアのダイナミクスについて詳しい研究が報告されましたので,ご興味ある方は,Silver et al. (2010)をご覧ください。ヌクレオモルフには染色体が3本存在し,Bigelowiella natansの場合,末端部分にテロメア配列,そのあと,末端から順にSSU rRNA, 5.8S rRNA, LSU rRNA遺伝子があります(図8)。(注:Silver et al. (2010) により,系統群ごとに遺伝子の並びが異なることが示されました。)ヌクレオモルフは,共生藻の核が完全に消失する前の段階にあると考えられ,かつて核として機能していた遺伝子の大部分は失われたか,宿主の核へ転移したと考えられていますが,葉緑体で働くタンパク質をコードしている遺伝子や,ハウスキーピング遺伝子など,少数の遺伝子がまだヌクレオモルフに残されています (Gilson et al. 2006)。次の表でクリプト植物とクロララクニオン植物のヌクレオモルフの特徴を比較しました。 |
| |
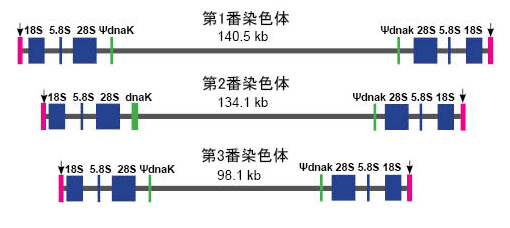 |
| 図8. ヌクレオモルフ染色体の概略図(Bigelowiella natansの例)。各染色体の末端部(矢印)にはテロメア配列(5’-TCTAGGG-3’)24-45 が存在する。図中に表記してある遺伝子以外は省略した。 |
| |
| 表1 クロララクニオン植物とクリプト植物のヌクレオモルフの比較(Archibald 2007より) |
| |
クリプト植物 |
クロララクニオン植物 |
| |
Guillardia theta |
Bigelowiella natans |
| 葉緑体の起源 |
紅藻 |
緑藻 |
| ゲノムサイズ |
551,264 bp |
372,870 bp |
| 染色体数 |
3本 |
3本 |
| 染色体構造 |
sub-telomeric inverted repeats |
sub-telomeric inverted repeats |
| テロメア配列 |
(5’-[AG]7AAG6A-3’)11 |
(5’-TCTAGGG-3’)25–45 |
| ゲノムAT含量: |
|
|
| 逆位反復配列 |
~55% |
~50% |
| シングルコピー DNA |
65–77% |
>65% |
| 遺伝子数: |
|
|
| タンパク質遺伝子 |
465 |
293 |
| 非mRNA |
47 |
42 |
| 偽遺伝子 |
1 |
5 |
| 合計 |
513 |
340 |
| 遺伝子密度 |
1.07 Kb/gene |
1.10 Kb/gene |
| 平均遺伝子間距離 |
70 bp |
113 bp |
| オーバーラップ遺伝子 |
40 |
なし |
| イントロン数(サイズ幅) |
17 (42–52 bp) |
852 (18–21 bp) |
| 葉緑体遺伝子 |
30 |
17 |
| |
| 系統・分類 |
| |
| ここではクロララクニオン植物の分類の歴史と現行の分類体系について解説したいと思います。クロララクニオン植物は2011年現在,8属14種が記載されています。最初に認識されたクロララクニオン植物であるChlorarachnion reptansは,1930年にカナリア諸島から発見され,Geitler によって黄緑藻綱(Xanthophyceae)に所属する藻として記載されました。C. reptansの報告から36年後の1966年,NorrisはメキシコのPuerto PeñascoからC. reptansを再発見し,フロラリストに報告しました (Norris 1967)。それからさらに約20年たった1984年,Hibberd & NorrisはC. reptansの培養株に基づいて,光学・電子顕微鏡および色素分析による詳細な再検討を行い,クロララクニオン植物は,①葉緑体はクロロフィルaおよびbを持つこと,②葉緑体は4重膜で囲まれていること,③葉緑体周縁区画にヌクレオモルフ様オルガネラを持つこと(後に共生核であることが確かめられた),④眼点を持たないこと,⑤同化産物はデンプンではないこと,などの形質を持つことを見出しました。これらの形質をセットで持つ生物を考えたところ,C. reptansは黄緑藻綱ではなく,これまでの藻類グループには当てはまらないユニークな生物であることが明らかになり,Hibberd & Norrisは新たにクロララクニオン植物門を設立しました (Hibberd & Norris 1984)。 |
| |
| 上で述べたように,クロララクニオン植物の栄養細胞は糸状仮足を持つアメーバ状を呈する種が多いですが,細胞壁を持つ球状の種,あるいは1本鞭毛を持った遊泳性の種も知られています。アメーバ状を呈する種は,混合栄養(光合成+餌の捕食)を行うことが確認されています。完全に独立栄養である不動の球状細胞を持つ種や,外洋の表層水環境への適応したと思われる遊泳性(プランクトン性)の種も知られています。このように,クロララクニオン植物は,様々な栄養摂取様式を持ち,沿岸域から外洋域まで生息域も多岐に渡っているため,生活環が非常に多様化しているのも特徴のひとつとして挙げられます。 |
| |
| 2011年現在,本植物には8属14種が知られており,すべて海産種のみで構成されています。属は,ピレノイド微細構造(上述の微細構造を参照),ヌクレオモルフの位置,および,栄養細胞のタイプで決められます。この形質セットで定義された属は,単系統群であり,分子系統学的な結果と矛盾しません(Ota et al. 2009など)。 |
| |
| クロララクニオン植物の分類体系(属以下はアルファベット順) |
| |
| クロララクニオン植物門 CHLORARACHNIOPHYTA Hibberd & Norris, 1984 |
| |
| |
クロララクニオン藻綱 Chlorarachniophyceae Hibberd & Norris, 1984 |
| |
| |
|
クロララクニオン目 Chlorarachniales Ishida & Y. Hara, 1996 |
| |
| |
|
|
クロララクニオン科 Chlorarachniaceae Ishida & Y. Hara, 1996(注) |
| |
| |
|
|
|
アモルフォクロラ属 Amorphochlora Ishida, Yabuki et S. Ota, 2011 |
| |
|
|
|
|
| |
|
|
|
|
Amorphochlora amoebiformis (Ishida et Y.Hara) Ishida, Yabuki et S. Ota, 2011 |
| |
|
|
|
|
| |
|
|
|
ビゲロウィエラ属 Bigelowiella Moestrup, 2001 |
| |
| |
|
|
|
|
Bigelowiella natans Moestrup, 2001 |
| |
|
|
|
|
Bigelowiella longifila S. Ota & Ishida, 2007b |
| |
| |
|
|
|
クロララクニオン属 Chlorarachnion Geitler 1930 emend. Ishida & Y. Hara, 1996 |
| |
|
|
|
|
|
| |
|
|
|
|
Chlorarachnion reptans Geitler, 1930 |
| |
|
|
|
|
|
| |
|
|
|
クリプトクロラ属 Cryptochlora Calderon-Saenz & Schnetter, 1987 |
| |
|
|
|
|
|
| |
|
|
|
|
Cryptochlora perforans Calderon-Saenz & Schnetter, 1987 |
| |
|
|
|
|
|
| |
|
|
|
ギムノクロラ属 Gymnochlora Ishida & Y. Hara, 1996 |
| |
|
|
|
|
| |
|
|
|
|
Gymnochlora dimorpha S. Ota, 2011a |
| |
|
|
|
|
|
| |
|
|
|
|
Gymnochlora stelalta Ishida & Y. Hara, 1996 |
| |
|
|
|
|
|
| |
|
|
|
ロタレラ属 Lotharella Ishida & Y. Hara, 1996 |
| |
|
|
|
|
| |
|
|
|
|
Lotharella globosa Ishida & Y. Hara, 1994 |
| |
|
|
|
|
Lotharella oceanica S. Ota, 2009a |
| |
|
|
|
|
Lotharella polymorpha Dietz, Ehlers, Wilhelm, Gil-Rodríguez & Schnetter, 2003 |
| |
|
|
|
|
Lotharella reticulosa S. Ota, 2011a |
| |
|
|
|
|
Lotharella vacuolata S. Ota & Ishida, 2005 |
| |
|
|
|
|
|
| |
|
|
|
ノリシエラ属 Norrisiella S. Ota & Ishida, 2007a |
| |
|
|
|
|
|
| |
|
|
|
|
Norrisiella sphaerica S. Ota & Ishida, 2007a |
| |
|
|
|
|
|
| |
|
|
|
パルテンスキエラ属 Partenskyella S. Ota, 2009b |
| |
|
|
|
|
|
| |
|
|
|
|
Partenskyella glossopodia S. Ota, 2009b |
| |
| (注)植物命名規約では科のレベルの名前は優先権を持ちます。Chlorarachniaceaeという科の学名はIshida & Y. Hara 1996より先にPascherが発表しているため,Chlorarachniaceae Pascher 1939となる可能性がありますが,この学名が有効かどうか精査中ですので,暫定的にIshida & Y. Hara 1996としました。 |
| |
| クロララクニオン植物の種レベルの形質としては,主に生活環のパターンが用いられています。これはクロララクニオン植物が球状かアメーバ状であることが多く,光学顕微鏡的な形質が乏しいためです。つまり,球状細胞の場合は単に丸い細胞のため使える形質が少なく,逆にアメーバ状細胞の場合は刻々と細胞の形が変わるため(つまり,形態的可塑性が大きいため),形質が不安定となります。このため,クロララクニオン植物の場合,細胞形態に代わるような形質を導入して種を識別する必要がありました。そのもっとも有用な形質として,生活環があります。ここで,Lotharella属の例を挙げてみます。話を簡単にするため,L. globosaとL. vacuolataで比較してみます。L. globosaは栄養細胞が球状ですが,古いカルチャーを新しく植え替えた場合,遊泳細胞が出現します。L. vacuolataも同様に,栄養細胞が球状で,古いカルチャーを新しく植え替えた場合,遊泳細胞が出現します。ここまでは両者で一緒ですが,L. vacuolataではさらに,生活環の一部にアメーバ状細胞が出現します。このアメーバ状細胞は,実は親細胞(球状細胞)の中で二分裂した娘細胞の片方が外に出てきたものです。もう片方は親細胞のなかに留まったまま外に出ません。外に出たアメーバ状の娘細胞はやがて球状細胞に戻ります。興味深いのは,必ず娘細胞の片方だけが親細胞から出て行き,両方とも出たり,両方とも親細胞に留まったりすることはありません(詳しくは,Ota et al. 2005, Ota 2010を参照してください)。一方,L. globosaではアメーバ状ステージがなく,細胞の増殖が起こります。このように,時間軸を入れて培養株を観察してみると,表面的に栄養細胞が似ていても,全く異なる実体であることが分かります。 |
| |
| クロララクニオン植物は,渦鞭毛植物やクリプト植物などと異なり,サンプリングすれば必ず見つかるようなものではありません。私の経験上,生息地の異なる100箇所の砂,海藻サンプルを予備培養して,クロララクニオン植物が見つかるのはわずか数箇所,多くても10箇所程度です。このため培養株を発見,確立するのが比較的難しく,分類学的研究のひとつの障壁となっています。逆に言えば,まだまだ新種の出現する可能性は高く,記載分類学的研究を行う上ではおもしろいグループといえます。最終的にどれくらいの多様性を持っているのかまだ分かりませんが,珊瑚礁域あるいは逆に寒帯での調査を続けることで,少なくとも現在の種数を倍にするくらいの多様性はありそうです。 |
| |
| 進化 |
| |
| ここでは簡単にクロララクニオン植物の進化について触れてみたいと思います。ここではクリプト植物と比較しながら考えて見ます。クリプト植物は前述のようにヌクレオモルフを持つ別のグループで,宿主,共生藻ともにクロララクニオン植物と起源はまったく異なります。クリプト植物には光合成能を二次的に失ったCryptomonas parameciumや,葉緑体を獲得した系統群と姉妹関係になる(つまり葉緑体を獲得する前に分岐したと考えられる)従属栄養性のGoniomonasが知られています。クロララクニオン植物では二次的に葉緑体を失った群に相当する種は知られていません。また現時点で報告されている分子系統解析によると,クロララクニオン植物ケルコゾア生物のフィローサ類に属しますが,フィローサのどの群と姉妹関係となるのかは,分子系統解析の統計的サポートが弱いため,まだはっきりと結論するに至っていません。しかし最近のメタゲノム研究により,クロララクニオン植物と姉妹関係になる塩基配列が見つかってきています(未発表)。しかもこの群はかなり強い統計的支持でクロララクニオン植物と単系統になると示唆されています。もしこの配列に相当する生物が無色(従属栄養性生物)であるなら,現時点ではクロララクニオン植物にもっとも近い従属栄養性ケルコゾア生物であり,クリプト植物で例えると,Goniomonasに相当する生物となる可能性があります。現在,この塩基配列を持った生物の培養株が確立されていないため,これ以上のことは分からず,このため培養株の分離に基づいた分類学的研究が待たれています。 |
| |
| 葉緑体タンパク質の輸送経路,メカニズムの解明 |
| |
| 最後にクロララクニオン植物と現代生物学の接点について簡単に触れてみたいと思います。以下の説明は簡潔に書いてありますので,詳しくは引用文献などをご参照ください。現在の植物学および進化細胞生物学における主要テーマのひとつに「細胞内共生からどのような過程を経てオルガネラとなったか?」というテーマがあります。簡単に言うと,おそらく当初「餌」として細胞内に取り込んだ生物をどのように飼いならして宿主細胞の支配下に置いたかという問題です。これを達成するには,共生者の遺伝子を取り上げてしまい,共生者が独自に生きられなくすることが知られています(遺伝的統合)。共生者にとっては生きていくための遺伝子がないわけですから,代謝などが維持できませんので,最低限必要なタンパク質を供給しなければなりません。宿主核にコードされていて,葉緑体(共生者)に輸送されるタンパク質を特に「核コード葉緑体タンパク質」と呼んでいますが,この核コード葉緑体タンパク質がどのような機構,経路で輸送されるかを解明する研究が進められています。クロララクニオン植物やクリプト植物の場合,共生者の痕跡的核(ヌクレオモルフ)を持っており,葉緑体獲得過程において,進化的中間段階と考えられています。このような葉緑体獲得の途中段階の生物群がどのような核コード葉緑体タンパク質の輸送経路を持っているかという問題は,興味がもたれるところです。クロララクニオン植物ではどのような輸送機構を進化させたのか,さらにほかの植物群と比較してどの点が似ていて,どの点が異なるのかを調べる研究が行われています。この研究はまだ始まったばかりですが,最近,細胞進化学的にに重要な知見を蓄積し始めています(たとえば,Hirakawa et al. 2009; Hirakawa et al. 2010,和文総説として,石田ら(2007))。 |
| |
| 最後に |
| |
| 生物学だけでなく自然科学全般に言えることですが,最近では分野の細分化,専門化が進み,最先端の研究を網羅的に把握するのは難しくなってきました。本ウエブサイト『生きもの好きの語る自然誌』では,植物・原生生物における最先端の分類学,進化学を中心にタイムリーな情報を提供していきたいと思います。また,クロララクニオン植物の研究も最近では盛んに行われ,一年も経つと情報は古くなってしまいます。クロララクニオン植物のページでは,ウエブサイトの利点を活かして随時更新し,新知見紹介していきたいと考えております。次回第3版をご期待ください。 |
| |
| 参考文献 |
| (アルファベット順。和文文献は英文の後に掲載しています。) |
| |
| Archibald, J. M. 2007. Nucleomorph genomes: structure, function, origin and evolution. Bio Essays 29: 392–402. |
| |
| Bass, D. and Cavalier-Smith, T. 2004. Phylum-specific environmental DNA analysis reveals remarkably high global biodiversity of Cercozoa (Protozoa). International Journal of Systematic and Evolutionary Microbiology 54: 2393-2404. |
| |
| Bass, D., Chao, E.E., Nikolaev, S., Yabuki, A., Ishida, K., Berney, C., Pakzad, U., Wylezich, C. and Cavalier-Smith, T. 2009. Phylogeny of novel naked Filose and Reticulose Cercozoa: Granofilosea cl. n. and Proteomyxidea revised. Protist 160: 75-109. |
| |
| Bass, D., Moreira, D., López-García, P., Polet, S., Chao, E.E., von der Heyden, S., Pawlowski, J. and Cavalier-Smith, T. 2005. Polyubiquitin insertions and the phylogeny of Cercozoa and Rhizaria. Protist 156: 149-161. |
| |
| Bhattacharya, D., Helmchen, T. and Melkonian, M. 1995. Molecular evolutionary analyses of nuclear-encoded small subunit ribosomal RNA identify an independent rhizopod lineage containing the Euglyphina and the Chlorarachniophyta. Journal of Eukaryotic Microbiology 42: 65-69. |
| |
| Burki, F., Inagaki, Y., Bråte, J., Archibald, J., Keeling, P., Cavalier-Smith, T., Sakaguchi, M., Hashimoto, T., Horak, A., Kumar, S. et al. 2009. Large-scale phylogenomic analyses reveal that two enigmatic protist lineages, telonemia and centroheliozoa, are related to photosynthetic chromalveolates. Genome Biology and Evolution 27: 231-238. |
| |
| Burki, F. and Pawlowski, J. 2006. Monophyly of Rhizaria and multigene phylogeny of unicellular bikonts. Molecular Biology and Evolution 23: 1922-1930. |
| |
| Burki, F., Shalchian-Tabrizi, K. and Pawlowski, J. 2008. Phylogenomics reveals a new ‘megagroup’ including most photosynthetic eukaryotes. Biology Letters 4: 366-369. |
| |
| Calderon-Saenz, E., and Schnetter, R. 1987. Cryptochlora perforans, a new genus and species of algae (Chlorarachniophyta), capable of penetrating dead algal filaments. Plant Systematics and Evolution 158: 69-71. |
| |
| Cavalier-Smith, T. 1998. A revised six-kingdom system of life. Biology Reviews 73: 203-266. |
| |
| Cavalier-Smith, T. 2010. Kingdoms Protozoa and Chromista and the eozoan root of the eukaryotic tree. Biology Letters 6: 342-345. |
| |
| Cavalier-Smith, T., Lewis, R., Chao, E.E., Oates, B. and Bass, D. 2008. Morphology and Phylogeny of Sainouron acronematica sp. n. and the ultrastructural unity of Cercozoa. Protist 159: 591-620. |
| |
| Dietz, C., Ehlers, K., Wilhelm, C., Gil-Rodríguez, M.C. and Schnetter, R. 2003. Lotharella polymorpha sp. nov. (Chlorarachniophyta) from the coast of Portugal. Phycologia 42: 582-593. |
| |
| Geitler, L. 1930. Ein grünes Filarplasmodium und andere neue Protisten. Archiv für Protistenkunde 69: 615–636. |
| |
| Gilson, P., Su, V., Slamovits, C., Reith, M., Keeling, P. and McFadden, G. 2006. Complete nucleotide sequence of the chlorarachniophyte nucleomorph: nature's smallest nucleus. Proceedings of the National Academy of Sciences of the United States of America 103: 9566-9571. |
| |
| Hibberd, D.J. and Norris, R.E. 1984. Cytology and ultrastructure of Chlorarachnion reptans (Chlorarachniophyta divisio nova, Chlorarachniophyceae classis nova). Journal of Phycology 20: 310–330. |
| |
| Hirakawa, Y., Gile, G.H., Ota, S., Keeling, P.J. and Ishida, K. 2010. Characterization of periplastidal compartment–targeting signals in chlorarachniophytes. Molecular Biology and Evolution 27: 1538-1545. |
| |
| Hirakawa, Y., Nagamune, K. and Ishida, K. 2009. Protein targeting into secondary plastids of chlorarachniophytes. Proceedings of the National Academy of Sciences of the United States of America 106: 12820-12825. |
| |
| Ishida, K., Green, B.R. and Cavalier-Smith, T. 1999. Diversification of a chimaeric algal group, the chlorarachniophytes: phylogeny of nuclear and nucleomorph small-subunit rRNA genes. Molecular Biology and Evolution 16: 321-331. |
| |
| Ishida, K. and Hara, Y. 1994. Taxonomic studies on the Chlorarachniophyta. I. Chlorarachnion globosum sp. nov. Phycologia 33: 351-358. |
| |
| Ishida, K., Nakayama, T. and Hara, Y. 1996. Taxonomic studies on the Chlorarachniophyta. II. Generic delimitation of the chlorarachniophytes and description of Gymnochlora stellata gen. et sp. nov. and Lotharella gen. nov. Phycological Research 44: 37-45. |
| |
| Ishida, K., Yabuki, A. and Ota, S. 2011. Amorphochlora amoebiformis gen. et comb. nov. (Chlorarachniophyceae). Phycological Research 59: 52-53. |
| |
| Keeling, P.J. 2001. Foraminifera and Cercozoa are related inactin phylogeny: two orphans find a home? Molecular Biology and Evolution 18: 1551–1557. |
| |
| McFadden, G.I., Gilson, P.R., Hofmann, C.J.B., Adcock, G.J. and Maier, U.-G. 1994. Evidence that an amoeba acquired a chloroplast by relating part of an engulfed eukaryotic alga. Proceedings of the National Academy of Sciences of the United States of America 91: 3690-3694. |
| |
| Medlin, L., Metfies, K., Mehl, H., Wiltshire, K. and Valentin, K. 2006. Picoeukaryotic plankton diversity at the Helgoland time series site as assessed by three molecular methods. Microbial Ecology 52: 53-71. |
| |
| Moestrup, Ø., and Sengco, M. 2001. Ultrastructural studies on Bigelowiella natans, gen. et sp. nov., a chlorarachniophyte flagellate. Journal of Phycology 37: 624-646. |
| |
| Norris, R.E. 1967. Micro-algae in enrichment cultures from Puerto Peñasco, Sonora, Mexico. Bulletin of the California Academy of Sciences 66: 233–50. |
| |
| Not, F., Gausling, R., Azam, F., Heidelberg, J.F. and Worden, A.Z. 2007. Vertical distribution of picoeukaryotic diversity in the Sargasso Sea. Environmental Microbiology 9: 1233–1252. |
| |
| Ota, S. 2010. Unique behavior of daughter cells in chlorarachniophytes. In: Daughter Cells: Properties, Characteristics, and Stem Cells. A. Hitomi, and M. Kataoka, eds. Nova Science Publishers, Hauppauge, New York, pp. 293-304. |
| |
| Ota, S., Kudo, A. and Ishida, K. 2011a. Gymnochlora dimorpha sp. nov., a chlorarachniophyte with unique daughter cell behaviour. Phycologia 50: 317-326. |
| |
| Ota, S., Silver, T.D., Archibald, J.M. and Ishida, K. 2009a. Lotharella oceanica sp. nov. – a new planktonic chlorarachniophyte studied by light and electron microscopy. Phycologia 48: 315-323. |
| |
| Ota, S., Ueda, K. and Ishida, K. 2005. Lotharella vacuolata sp. nov., a new species of chlorarachniophyte algae, and time-lapse video observations on its unique post-cell division behavior. Phycological Research 53: 275-286. |
| |
| Ota, S., Ueda, K. and Ishida, K. 2007a. Norrisiella sphaerica gen. et sp. nov., a new coccoid chlorarachniophyte from Baja California, Mexico. Journal of Plant Research 120: 661-670. |
| |
| Ota, S., Ueda, K. and Ishida, K. 2007b. Taxonomic study of Bigelowiella longifila sp. nov. (Chlorarachniophyta) and a time-lapse video observation on the unique migration of amoeboid cells. Journal of Phycology 43: 333-343. |
| |
| Ota, S., Vaulot, D., Le Gall, F., Yabuki, A. and Ishida, K. 2009b. Partenskyella glossopodia gen. et sp. nov., the first report of a chlorarachniophyte that lacks a pyrenoid. Protist 160: 137-150. |
| |
| Ota, S. and Vaulot, D. 2011b. Lotharella reticulosa sp. nov.: a highly reticulated network forming chlorarachniophyte from the Mediterranean Sea. Protist (in press) doi: 10.1016/j.protis.2011.02.004. |
| |
| Pascher, A. 1939. Heterokonten. In: Rabenhorst’s Kryptogamen-Frora. 2 Auflage, Band 11 (herausgegeben von Prof. Dr. R. Kolkwitz, Berlin) Akademische Verlagsgesellschaft, Leipzig. |
| |
| Richards, T. and Bass, D. 2005. Molecular screening of free-living microbial eukaryotes: diversity and distribution using a meta-analysis. Current Opinion in Microbiology 8: 240-252. |
| |
| Silver, T.D., Koike, S., Yabuki, A., Kofuji, R., Archibald, J.M. and Ishida, K. 2007. Phylogeny and nucleomorph karyotype diversity of chlorarachniophyte algae. Journal of Eukaryotic Microbiology 54: 403-410. |
| |
| Silver, T.D., Moore, C.E. and Archibald, J.M. 2010. Nucleomorph ribosomal DNA and telomere dynamics in chlorarachniophyte algae. Journal of Eukaryotic Microbiology 57: 453-459. |
| |
| Takahashi, F., Okabe, Y., Nakada, T., Sekimoto, H., Ito, M., Kataoka, H. and Nozaki, H. 2007. Origins of the secondary plastids of Euglenophyta and Chlorarachniophyta as revealed by an analysis of the plastid-targeting, nuclear-encoded gene psbO. Journal of Phycology 43: 1302-1309. |
| |
| 石田健一郎・小池さやか・平川泰久 2007. 葉緑体の誕生と水平伝播. In: 細胞工学別冊 植物細胞工学シリーズ23「植物の進化」, 清水健太郎・長谷部光泰 (編). 秀潤社, pp. 183-191.
|
| |
| 井上 勲 2007. 藻類30億年の自然史―藻類からみる生物進化・地球・環境. 東海大学出版会,神奈川. |
| |
| |
| >藻類・原生生物の分類と解説 |
| |
| 「生きもの好きの語る自然誌」のトップに戻る |
| |
| © 2010 Shuhei Ota |
|








